O fósforo, no solo, encontra-se na fase sólida – orgânica e inorgânica, e na fase líquida – solução do solo. Nesta solução ele está presente como ânions H2PO4 e HPO4 e sua concentração é menor que 0,01 mg/dm³. Esta é apenas uma pequena fração do fósforo total, e é a forma solúvel que as plantas absorvem. A absorção do fósforo pelas plantas se verifica sob a forma de ânions encontrados na solução do solo: o ânion H2PO4 predomina em solos ácidos e é chamado de ortofosfato primário; o ânion HPO4 em solos alcalinos e é chamado de ortofosfato secundário.
Tem sido adotada a expressão elementar de P para indicar os teores de fósforo ao invés de indicar o óxido P2O5. As plantas não utilizam nem o elemento puro e nem a forma de óxido (P2O5). É mais uma diferença acadêmica do que prática. Usam-se conversões como:
P2O5 x 0,437 = PTem sido adotada a expressão elementar de P para indicar os teores de fósforo ao invés de indicar o óxido P2O5. As plantas não utilizam nem o elemento puro e nem a forma de óxido (P2O5). É mais uma diferença acadêmica do que prática. Usam-se conversões como:
P x 2,29 = P2O5
Na dissociação, há formação de H+ que ocasiona um abaixamento do pH ao redor do grânulo de adubo.
Nos fertilizantes, o fósforo precisa combinar-se com hidrogênio, cálcio, oxigênio e outros elementos, porque as plantas não podem usá-lo, como os demais nutrientes, na sua forma elementar ou pura: na forma elementar, o fósforo queima-se quando em contato com o ar; o nitrogênio é um gás inerte, sem cor; o potássio se queima quando em contato com a água.
O teor de P2O5 em um fertilizante é expresso em porcentagem (%); é considerado prontamente disponível para as plantas em crescimento. Ele tem sido utilizado tradicionalmente para expressar o fósforo disponível. É chamado, também, óxido de fósforo, ou pentóxido de fósforo, ou anidrido fosfórico. Na realidade, o P2O5 nunca é encontrado como tal nos fertilizantes, mas o teor de fósforo contido neles tem sido expresso em P2O5%. É mais do ponto de vista histórico, tradição. Em ácidos onde não se verifica a presença de molécula de água ou, pelo contrário, se tem a presença de mais de uma molécula de água, ocorre o seguinte: 2 x H3PO4 = H6P2O8
3 x H2O = H6O3
H6P2O8 - H6O3 = P2O5
3 x H2O = H6O3
H6P2O8 - H6O3 = P2O5
No material de origem do solo, o P encontra-se na forma mineral, em maior parte, como fosfato de cálcio. Pela ação do intemperismo e de outros fatores que atuam na formação do solo, o fósforo é liberado para a solução do solo. Parte do fósforo é “adsorvida” pelos minerais secundários, e parte é “absorvida” e incorporada pelos microorganismos do solo; isto faz com que aumente a proporção de fósforo orgânico. Apesar do fósforo total do solo ser muito grande, apenas uma parte dele está em equilíbrio com o fósforo da solução do solo, e pode ser utilizada pelas plantas durante o seu desenvolvimento. Esta fração de P total é chamada “lábil” e é avaliada através de extratores na análise do solo.
Os solos são deficientes em fósforo devido ao processo de fixação; as plantas precisam de fósforo para produzir grãos e frutos; a exportação de P pelos vegetais é grande, correspondendo até 0,5% da massa seca.
Na maior parte dos solos, a solução do solo é muito baixa em concentração de nutrientes. Entretanto nesta solução fraca passam bilhões de íons por meio de complexos de troca e processos de difusão, com a finalidade de prover as raízes das plantas e a partir delas as folhas, grãos e frutos. Porém, muitos fatores afetam estes processos: disponibilidade de água; suprimento de oxigênio; atividade microbiana; temperatura do solo; e concentração de nutrientes.
O suprimento de oxigênio é um fator muito crítico, pois faltando o oxigênio a produção de energia pelas raízes é comprometida, e, com isto, a absorção de nutrientes é limitada. É o caso dos solos inundados ou com má drenagem.
Quanto à temperatura, solos frios reduzem o processo de absorção porque a produção de energia respiratória é prejudicada. Nestas condições ocorrem deficiências de fósforo e zinco.
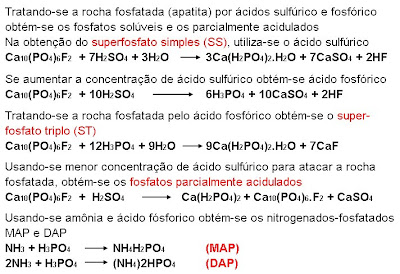
A rocha fosfatada é a principal fonte de fósforo: são os fosfatos naturais. Estes podem ser ígneos ou sedimentares. Os ígneos, de origem vulcânica, são de baixa eficiência agronômica; sua reatividade, no solo, é quase zero; são de baixa solubilidade nos extratores ácidos fórmico e cítrico; são insolúveis em água. As rochas sedimentares, por sua vez, formadas por depósitos de animais marinhos, são brandas, estrutura frágil, com maior substituição isomórfica; são mais reativas, pois sua solubilidade em extratores ácidos é maior, apesar de serem insolúveis em água; sua eficiência agronômica é mais alta.
Na minha opinião, considero fosfatos naturais reativos para aplicação direta na agricultura: quando forem de origem sedimentar com alta brandura; apresentarem alto teor de fósforo solúvel no ácido fórmico 2% relação 1:100; terem mais de 55% do fósforo total solúvel no ácido fórmico 2% 1:100; aplicados em pó ou submetidos a uma granulação soft que os permitam, em contato com a umidade do solo, voltarem rapidamente à forma de pó.
Para que haja aproveitamento do P pelas plantas é preciso que ocorra a dissolução da apatita: Ca10(PO4)6 + H = Ca + HPO4
Então, a eficiência do fosfato natural será maior em solos ácidos, onde o Al não seja limitante, e em solos com P e Ca baixos. Em solos com alto teor de Ca e pH maior que 5,5 esta eficiência agronômica cairá porque a reação de dissolução não encontrará condições favoráveis. Por causa disto, a indústria de fertilizantes utiliza ácidos para romper a estrutura cristalina dos fosfatos naturais pouco reativos com a finalidade de aumentar a sua eficiência agronômica.
Nos fosfatos parcialmente acidulados, oriundos do tratamento da rocha fosfatada com uma menor quantidade de ácido sulfúrico, uma parte do fósforo torna-se solúvel em água e a outra continua insolúvel em água. A Legislação de Fertilizantes, no caso dos fosfatos parcialmente acidulados, obriga garantir o teor de P2O5 solúvel em citrato neutro de amônio (CNA) + água. Os teores de P2O5 solúvel em água e total somente quando são vendidos isoladamente. Nestes fosfatos, tem-se uma liberação imediata do fósforo (vindo da solubilização) e a outra parte permanece insolúvel.
O fósforo solúvel em água reage instantaneamente no solo liberando grandes quantidade de fósforo que são adsorvidos aos colóides do solo. O fornecimento de P às plantas dependerá da reatividade do fósforo e da capacidade do solo de fixá-lo. Por isto os fosfatos devem ser aplicados no momento da semeadura, pois a ligação com os colóides do solo torna-se muito forte com o passar do tempo; além disto, os fosfatos devem ser aplicados em grânulos e na linha de semeadura para diminuir a área de contato com os colóides inorgânicos e tornar menor a adsorção.
E os fosfatos naturais reativos quando aplicados diretamente no solo? Os fosfatos naturais reativos (falo somente em reativos), pelo contrário, devem aumentar a área de contato com os colóides do solo e devem ser aplicados a lanço e incorporados ao solo.
Lembre-se! Só haverá liberação de P : quando o solo fornecer H para a reação; quando o P e Ca da solução, que foram liberados pela dissolução, sejam consumidos.

Bom dia Gastão,
ResponderExcluirInterpretando a minha análise do solo, verificando principalmente o Fósforo (P mg/dm3), quantos porcentos a planta consegue absorver da minha análise de solo?
Grato!
Em geral, os solos são tão deficientes em fósforo que torna-se necessário fosfatagem e adubação de manutenção. Cada planta, para completar seu ciclo, exporta uma certa quantidade de fósforo. O fósforo deve estar presente no solo em quantidades suficientes para que as plantas o absorvam, na solução do solo. Quanto a planta vai absorver de fósforo da análise do solo é impossível dar um número. Vai depender do tipo de solo, da eficiência de liberação do fósforo e outras mais.
ExcluirA análise dá o teor de P presente no solo, e por meio de tabelas de recomendação de adubação é proposta uma quantidade de fosfato a ser aplicado, conforme a cultura. A recomendação já leva em conta o teor de P exportado pela cultura e a eficiência dos fosfatados no solo.