Uma das preocupações de técnicos, estudantes e produtores é como calcular as quantidades de matérias-primas de fertilizantes para que se consiga uma fórmula de adubo que se deseja ou foi recomendada para aplicar na lavoura. Muitos preferem comprar as matérias-primas e misturá-las na propriedade: para isto necessitam de um misturador. As empresas de fertilizantes fazem isto no seu parque industrial; só de que maneira mais complexa, pois precisam de granuladores, misturadores, ensacadeiras, laboratórios de qualidade, etc., e, finalmente, comercializar e entregar o produto.
Tenho recebido alguns e-mails de pessoas interessadas em misturar os fertilizantes simples na sua propriedade. Aqui vai uma série de passos a serem seguidos.
As garantias expressas na Tabela 1 são mínimas exigidas pela Legislação Brasileira de Fertilizantes. Podemos encontrar produtos com valores maiores em nutrientes. Produtos com valores abaixo do mínimo não podem ser comercializados.
Obtenção de uma fórmula 00-20-20.
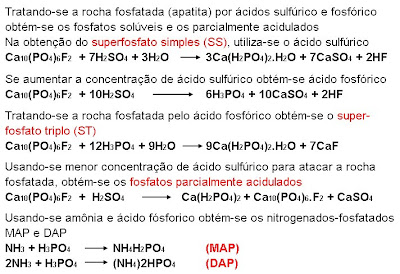
Utilizaremos o cloreto de potássio com 60% de K2O, o super fosfato triplo com 42% de P2O5 e o superfosfato simples com 18% de P2O5.
O que devemos ter em mente é que toda a formulação de fertilizante é calculada para 1.000 kg do produto.
Quando se fala que um produto, no caso supertriplo, tem 42% de P2O5, isto quer dizer que em 100 kg de supertriplo teremos 42 kg de P2O5.
1° Passo:
Começamos sempre pelo potássio pois em 90% dos casos a única matéria-prima mais utilizada como fornecedora de potássio (K2O) é o cloreto de potássio (KCl).
Empregaremos a fórmula:
Logo, aplicando a fórmula acima,
KCl kg = (20/60) x 1000 = 335 kg (arredondando).
Portanto, já temos uma matéria-prima que vai fornecer os 20 da fórmula 00-20-20, ou seja, 335 kg de cloreto de potássio.
2° Passo:
Então, 1.000 – 335 = 665 kg que faltam para completar a tonelada de fertilizante misturada e que devemos partir para fertilizantes simples fosfatados a fim de conseguir os outros 20 da fórmula.
Se utilizássemos somente o supertriplo vamos chegar a uma concentração de fósforo na mistura.
Empregando a fórmula abaixo teremos:
Onde:
NF = % de nutriente na mistura.
QMP = quantidade de matéria-prima.
TN = teor de nutriente na matéria-prima.
Aplicando:
NF(P2O5) = (665x42) / 1.000 = 27,9% de P2O5. Arredondando: 28
Ora, neste caso, teríamos a fórmula de adubo 00-28-20.
Mas não queremos 28% de P2O5. Nossa meta é 20% de P2O5.
Para isto precisamos adicionar um outro fertilizante fosfatado com menor teor de fósforo. Vamos utilizar, neste caso, o superfosfato simples que contém 18% de P2O5.
Precisamos lançar mão de equações matemáticas para atingir nosso objetivo. Seja, a = supertriplo e b = superfosfato simples.
(1) a + b = 665 ( a soma da quantidade dos dois superfosfatos deve ser 665 kg).
(2) 42a + 18b = 20000 ( a soma de cada matéria prima multiplicada pelo seu respectivo teor de nutriente deve nos dar os 20 de P2O5 que buscamos em 1000 quilos de mistura).
Se a + b = 665 logo a = 665 - b. Substituindo em (2):
42(665-b) + 18b = 20.000
27.930 – 42b + 18b = 20.000
-42b+ 18b = 20.000 – 27.930
-24b = - 7.930 ou 24b = 7.930
b = 7.930/24 = 330 kg de superfosfato simples.
Vimos que a = 665 – b
a = 665 – 330 ; a = 335 kg de superfosfato triplo.
3° Passo:
Aplicando as quantidade de matérias-primas utilizadas, nossa fórmula de fertilizante 00-20-20 estaria assim constituída em quantidade das mesmas e em garantias de nutrientes, conforme a tabela abaixo.
A nossa mistura 00-20-20 forneceria, também 4% de enxofre (S) e 10% de cálcio (Ca). Como lidamos com porcentagens, em cada 100 kg desta fórmula aplicada ao solo, a adição de nutrientes seria:
Zero kg de nitrogênio (N); 20 kg de fósforo (P2O5); 20 kg de potássio (K2O); 4 kg de enxofre (S); e 10 kg de cálcio (Ca).
Fácil, não é? Mas uma outra pergunta pode aparecer: e se eu quero uma mistura 05-30-15? Que tenha os três nutrientes: NPK. Então clique abaixo e acompanhe os cálculos para chegar à formulação 05-30-15.
Aqui temos a entrada do nitrogênio. É a única diferença. Mas vamos ao cálculo desta mistura de fertilizantes.
1° Passo:
Começaremos sempre do potássio.
Aplicando a fórmula do exercício anterior;
KCl = (15x60) / 1.000 = 250 kg de cloreto de potássio.
2° Passo:
Quando se tem o nitrogênio na fórmula de fertilizantes, após o potássio ele é o elemento a ser calculado em seguida. Vamos utilizar fertilizante simples nitrogenado ou nitrogenado-fosfatado.
A matéria-prima nitrogenada-fosfatada é a mais utilizada porque fornece, ao mesmo tempo, nitrogênio e fósforo. Vamos usar o DAP (diamônio fosfato) que contém 16% N e 45% de P2O5.
Precisamos 5% de N
Logo: aplicando o mesmo cálculo para achar a quantidade de cloreto de potássio, teremos:
DAP (kg) = 5/16 x 1.000 = 312,5 kg
Entretanto, o nosso DAP fornece, além do N, 45% de P2O5.
P2O5% do DAP = 312,5 x 46 /1.000 = 14,375 kg de P2O5.
Se não quiséssemos usar DAP, poderíamos utilizar uréia, ou sulfato de amônio. Faça os cálculos usando estes nitrogenados.
3° Passo:
É o mesmo raciocínio do exercício anterior. Precisamos de 30% de fósforo e o DAP já forneceu 14,375%. Faltam, portanto, 15,625% (30-14,375). Em termos de quantidades, até agora temos 250 kg de KCl e 312,5 kg de DAP que dão um total de 562,5 kg de matérias-primas. Faltam, então, 437,5 kg de produto a ser adicionado para completar os 1.000 quilos de mistura. Vamos utilizar os superfosfatos simples e triplo.
a + b = 437,5 quilos
a = 437,5 – b
42a + 18b = 15.625
42(437,5-b) + 18b = 15.625
18.375 – 42b + 18b = 15.625
-42b + 18b = 15.625 – 18.375
-24b = -2.750 ; multiplicando por (-1) 24b = 2.750
b = 2.750/24 = 114,5 kg de superfosfato simples
a = 437,5 – b ; a = 437,5 – 114,5 = 323 kg de supertriplo
A constituição de nossa mistura 05-30-15 estaria assim formada
A nossa mistura 05-30-15 forneceria, também 5% de enxofre (S) e 6% de cálcio (Ca). Como lidamos com porcentagens, em cada 100 kg desta fórmula aplicada ao solo, a adição de nutrientes seria:
5 kg de nitrogênio (N); 30 kg de fósforo (P2O5); 15 kg de potássio (K2O); 5 kg de enxofre (S); e 6 kg de cálcio (Ca).
 Na postagem "O Mamoeiro (1) - Calagem e Adubação via Solo" abordamos três tabelas de recomendação de nutrientes necessários e as quantidades de fertilizantes minerais para repor estes nutrientes. Nesta postagem vamos comentar a adubação via água (fertirrigação) e a periodicidade de aplicar os nutrientes durante o ciclo da planta. É claro que a consulta as Tabelas 1, 2 e 3 são necessárias.
Na postagem "O Mamoeiro (1) - Calagem e Adubação via Solo" abordamos três tabelas de recomendação de nutrientes necessários e as quantidades de fertilizantes minerais para repor estes nutrientes. Nesta postagem vamos comentar a adubação via água (fertirrigação) e a periodicidade de aplicar os nutrientes durante o ciclo da planta. É claro que a consulta as Tabelas 1, 2 e 3 são necessárias.